Kweekbloed en gentherapie voor patiënten met bloedarmoede
NieuwsSanquin wil in de toekomst voor mensen die bloedtransfusies nodig hebben, zoals patiënten met sikkelcelziekte of het Diamond-Blackfan anemie-syndroom, op grote schaal rode bloedcellen kweken. De onderzoekers gaan hiervoor gebruik maken van zogenaamde geïnduceerde pluripotente stamcellen. Een volgende stap is om dergelijke cellen, in dit geval afkomstig van de patiënt zelf, genetisch te repareren om de ziekte te genezen.
Geïnduceerde pluripotente stamcellen (iPSC) kunnen volgens Eszter Varga van iedere lichaamscel worden gemaakt. Zij is stamcelbioloog, senior postdoc en hoofd van de iPSC-faciliteit van Sanquin. Zelf maakt ze iPS-cellen vanuit witte bloedcellen uit donorbloed. `Daar voegen we bepaalde eiwitten – zogenaamde transcriptiefactoren - aan toe, zodat deze bloedcellen zich herprogrammeren naar een stadium alsof het embryonale stamcellen zijn. Deze stamcellen kun je weer alle richtingen uitsturen. Wij maken er rode bloedcellen van. Dit lukt al in het laboratorium, wat uniek is, maar we willen deze productie flink opschalen in bioreactoren. Met het kweekbloed hopen we mensen te behandelen die een bloedtransfusie nodig hebben maar voor wie het lastig of onmogelijk is transfusiebloed te vinden vanwege hun hele specifieke bloedgroepprofielen.’
TRACER
Binnen het Nederlandse project TRACER, waaraan naast hét bloedinstituut Sanquin ook enkele universiteiten meedoen, worden de iPS-cellen specifiek ingezet voor onderzoek naar sikkelcelziekte en het Diamond-Blackfan anemie-syndroom. Dit zijn erfelijke vormen van bloedarmoede. Bij sikkelcelziekte, in Nederland zeldzaam maar wereldwijd de meest voorkomende erfelijke aandoening, ligt de oorzaak in het ontstaan van misvormde rode bloedcellen die bovendien heel kort leven. Bij het zeldzame Diamond-Blackfan anemie-syndroom produceert het beenmerg onvoldoende rode bloedcellen. Beide ziekten kunnen gepaard gaan met vermoeidheid, kortademigheid en hartkloppingen. Sikkelcelziekte kent bovendien de risico’s van extreme pijnaanvallen en beroertes door blokkades in de aderen. Varga: `Binnen TRACER, dat staat voor TReating hereditary Anemias through stem CEll Research, gebruiken we iPS-cellen van patiënten voor het maken van ziektemodellen om beide vormen van bloedarmoede in het laboratorium te kunnen bestuderen. Met die modellen is het ook mogelijk nieuwe therapieën te testen. Omdat er in Nederland erg weinig patiënten deze ziekten hebben, is dit een welkom alternatief voor onderzoek.’
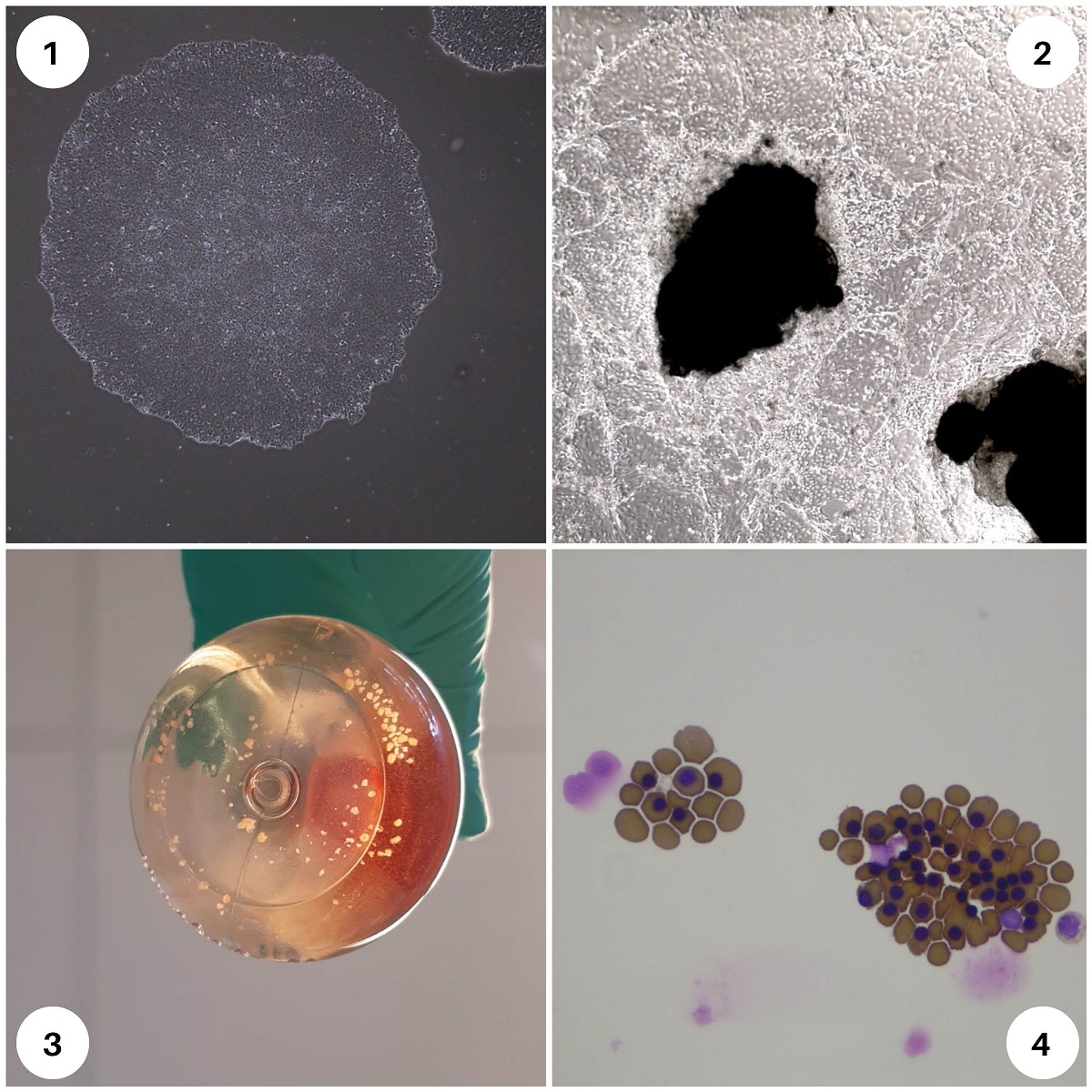
Afbeelding: We maken vanuit witte bloedcellen geïnduceerde pluripotente stamcellen (iPSC). Die ontwikkelen we verder tot rode bloedcellen. De iPSC-kolonies (1), worden organoiden (2,3). Deze zijn in staat om bloedcellen te produceren (4).
Geen afstoting
TRACER heeft daarnaast nog een ander doel. De onderzoekers willen de iPS-cellen ook gebruiken om gentherapie te onderzoeken. Het plan is om iPS-cellen te maken vanuit witte bloedcellen van een patiënt om daarin vervolgens de ziekmakende genen uit te schakelen of te repareren met de techniek CRISPR-Cas. Door deze patiënteigen iPS-cellen te laten uitgroeien tot beenmergcellen, is het mogelijk deze gezonde cellen aan de patiënt terug te geven. Als groot voordeel noemt Varga dat de match dan perfect is omdat het om lichaamseigen materiaal gaat. `Je hoeft dan niet bang te zijn voor afstotingsreacties, een klein risico dat wel bestaat bij donormateriaal. Die afweerreactie kan zelfs fataal zijn. Zoals gezegd kunnen we in het lab rode bloedcellen al vanuit iPS-cellen produceren maar voor beenmergcellen voor beenmergtransplantaties lukt dat nog niet. Daar maken we nu een stappenplan voor, waarmee vooral collega’s van mij bezig zijn. Een toekomstige combinatie van beenmergstamcelproductie uit iPSC en genetische reparatie van de ziekte zal bloedtransfusies tijdens het leven van de patiënten overbodig maken.’
Sociale en ethische vraagstukken
Om transfusies van kweekbloed en van genetisch gemodificeerde rode bloed- en beenmergcellen in de toekomst op een gepaste manier te doen, werkt Louisanne van Hooff aan de ethische en sociale vraagstukken van deze behandelingen. Zij is medisch antropoloog bij Sanquin en evenals Varga nauw betrokken bij TRACER. `Niet iedereen staat open voor gekweekt bloed en gentherapie. Veel mensen zijn huiverig voor het knutselen aan ons DNA. Daarom is het heel belangrijk om met de mensen om wie het gaat, in gesprek te gaan.’ Van Hooff interviewt niet alleen patiënten maar ook hun zorgverleners en familieleden. `We willen weten wat ze van die therapieën vinden en wat hun wensen zijn. We kijken ook welke culturele waarden eraan ten grondslag liggen.
Zo heb je bij sikkelcelziekte in ons land vaak te maken met mensen die voorouders hebben in landen in Afrika, ten zuiden van de Sahara. Sikkelcelziekte komt in Nederland daarom veel voor bij mensen afkomstig uit Suriname en het Caraïbisch gebied.
Verder kijken we ook bij welke zorgorganisaties de patiënten straks terechtkunnen.’ Een heikel onderwerp is volgens Van Hooff de toegankelijkheid van de behandelingen. `Die zijn namelijk nog peperduur. Enkele miljoenen euro per patiënt. Het mag niet zo zijn dat straks alleen welvarende mensen er gebruik van kunnen maken. Dat moeten we zien te voorkomen.’
Lees ook hoe Sanquin betrokken is bij Wereld Sikkelceldag op 19 juni, en de rol van Louisanne.
